片頭痛について
片頭痛は、ズキズキする拍動性の痛みで、悪心、嘔吐及び光過敏、音過敏を伴う頭痛の事です。
頭痛が、起こる頻度は人によって様々ですが、月に1~2回程度の症例が多く、少ない場合は、年に数回程度。多い例では週に1回程度認められます。
頭痛が出現する前に前兆として視覚症状、感覚症状、言語症状を伴うものがあります。
片頭痛の有病率
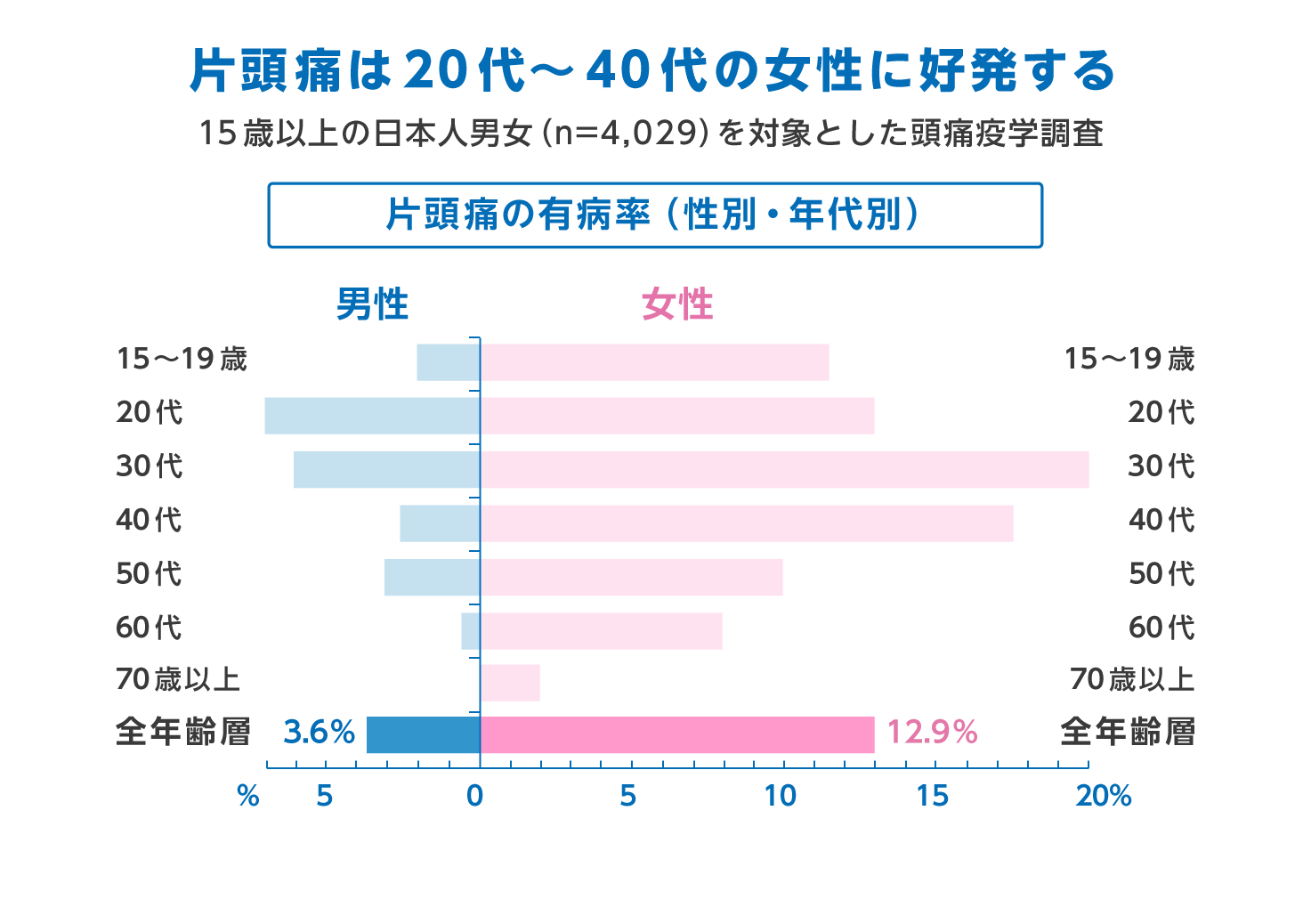
日本での片頭痛の有病率は、15歳以上では約8.4%と報告されています。うち男性が3.6%、女性が13%です。これは、欧米諸国でも同様です。
女性が男性よりも3倍片頭痛に悩まされているとされております。片頭痛の中で前兆がある片頭痛が、15%、前兆のない片頭痛が75%とされております。
片頭痛の病態
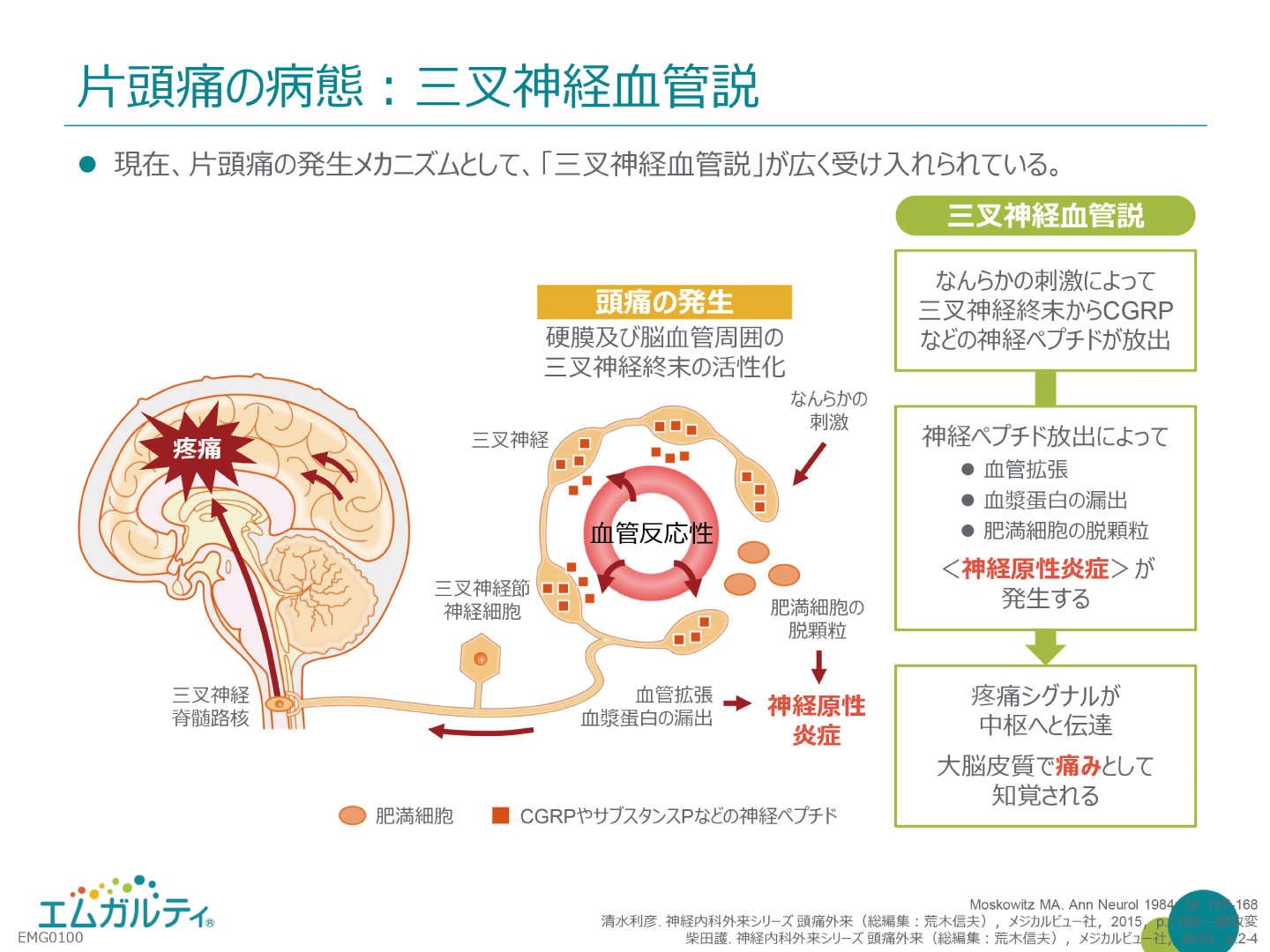
片頭痛の発生機序に確立された概念はないが、cortical spreading depression (CSD)という概念がある。前兆期に後頭葉の脳血流が低下する現象の事である。一方、頭痛に関しては三叉神経血管系の関与が言われている。三叉神経血管系とは、脳底部の主幹動脈から大脳皮質表面の軟膜動脈、及び硬膜血管において三叉神経節由来の無髄神経線維が分布している領域を総称するものです。何らかの刺激により硬膜の血管周囲に存在する三叉神経の軸索に作用し、神経終末からsubstance P やcalcitonin gene-related peptide (CGRP)などの神経伝達物質でありかう血管作動性物質の神経ペプチドの放出が起こると考えられています。更に硬膜周囲における肥満細胞等の活性。化により、神経原性炎症が惹起され疼痛が生じると考えられています。
片頭痛の症状
ズキズキする拍動性の痛みで
- 悪心
- 嘔吐
- 光過敏
- 音過敏
片頭痛は、上記症状があります。
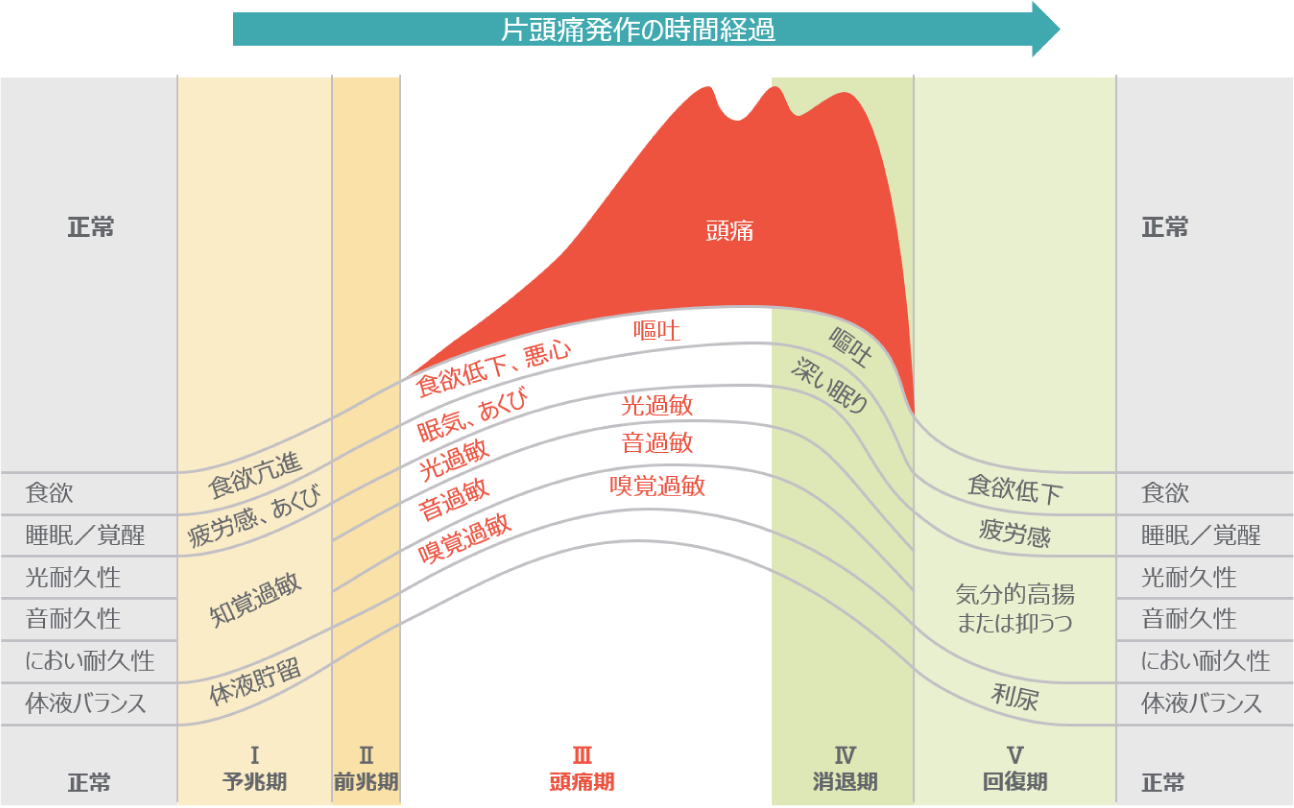
典型的前兆に片頭痛を伴うものは、予兆期、前兆期、頭痛期、消退期があります。
予兆期の症状
興奮性の症状
- 焦燥感
- 神経的抑揚
- 強迫観念
- あくび
- 過睡眠
- 光または音に対する過敏
- 食欲亢進
- 腸及び、膀胱機能の亢進
- 口渇感等
抑制性の症状
- 疲労
- 集中困難
- 思考緩慢
- 頸部のこり
- 顔面蒼白
- 食欲低下
- 便秘症
予兆期は、片頭痛発作の前に起こる体調の変化を示し、頭痛発作の数時間から1、2日前に認める事が多いです。予兆には上記の興奮性及び抑制性の症状があります。
前兆期の症状
-
視覚の前兆
閃輝暗点 -
感覚の異常
チクチクしたり、感覚が鈍麻があります。 -
言語の異常
言葉が出にくくなります。
上記症状は、2種類以上も出ることはありますが同時に起こる事は少なく順番に起こることが多いです。
前兆期は脳の局在性神経症状であり、頭痛の起こる直前または、発作中に出現します。前兆の主な症状としまして、視覚、感覚、言語及び運動の異常がおこります。運動の症状が起こるものを特に片麻痺性片頭痛と診断します。
頭痛期の症状、特徴
- 悪心
- 嘔吐
- 光過敏
- 音過敏
- 片頭痛が起こると4~72時間持続
- 不快感が生じるのは発作30分から1時間前
- 典型的な部位は、こめかみから目の周囲
片頭痛は頭痛が始まる前に頭部の不快感によって気づくことが多いと言われています。
その後、軽度の痛みから徐々に中等度から重度の頭痛へと強度を増していきます。
この時間は、一般的に30分から2時間とされています。
一度、片頭痛が生じると4~72時間持続します。
頭痛の典型的な部位としては、片側のこめかみから目の周囲が多く、拍動性もそしくは持続性の痛みを呈します。片頭痛患者様の60%はの患者は片側性ですが、両側性の頭痛を訴える方もいます。
頭痛の程度は、様々ですが日常生活に支障が出る程の症状の方も多くいます。
片頭痛発作時には、悪心、嘔吐を伴う他に光過敏症、音過敏症を認める事も多く認めます。また、匂いにも敏感になるほか、階段の上り下りの動作でも頭痛が増悪する事があります。
消退期、回復期
一部の患者様では、睡眠により頭痛が改善する事があります。
一方、小児では嘔吐で頭痛が改善する事があります。回復期に筋力低下、食欲低下、疲労感を訴える患者様もいます。
現在、片頭痛に関しては、内服、注射による予防が可能です。脳神経外科専門医によるきめ細かな疼痛予防、対策を行っていきます。
片頭痛を予防する習慣
-
①生活リズムを整える
寝不足、寝すぎにならないようにしましょう。睡眠は大切です。
-
②長時間のスマホやパソコンの使いすぎを気をつけましょう。
就寝2時間前は、使用を控えましょう。ブルーライトを遮断しましょう。
-
③ストレスをためないようにする
自分なりの気分転換方法等を見つけましょう。
-
④規則正しい食生活を心掛けましょう。
空腹は片頭痛の誘因となります。
-
⑤栄養
ビタミンB2やマグネシウムを摂りましょう。
片頭痛の頻度や持続時間を減らすと言われています。 -
⑥こんな食材は、避けましょう
ワイン、チーズ、チョコレートなどが言われております。
人によって誘因となる食品は違います。
自分で見つけて避けるようにしましょう。 -
⑦日差しを避ける
日差しによる視覚的な刺激は、誘発します。サングラスをしましょう。
-
⑧適度な運動
運動も規則正しい生活をする上で重要です。
-
⑨人混み、騒音、強いにおい
ストレスとなるものは、片頭痛の誘因となります。出来るだけ避けましょう。
当院で主に用いる片頭痛治療薬、予防薬
頭痛が起こった時、直前の急性期のお薬には下記があります。
NSAIDS製剤
●セレコックス
当院では主に、セレコックスを使用します。セレコックスは、COX-1には作用せず、COX-2に選択的に作用するため、胃を荒らす副作用が少ない痛み止めとされております。後は、効果が切れるのがゆっくりの為、急に切れる事による痛みを感じにくい(ロキソニンと比べて)のでよく使用します。
アセトアミノフェン製剤
●カロナール
胃に負担がかかりにくく、使いやすいお薬です。
肝臓に負担がかかる事がありますが、殆ど問題ありません。
トリプタン製剤
日本で使用可能な製剤にはの下記の5種類があり、それぞれ特長があります。
●スマトリプタン(イミグラン)
- イミグラン(スマトリプタン)は点鼻と錠剤、注射の3種類の剤型があります。
- イミグランの皮下注射は12分で効果発現があり即効性に優れます。
自己注射の為いつでも使えます。
妊娠中での使用データも豊富で、妊婦さんの頭痛増悪時にも、比較的安全に投与可能です。
●ゾーミッグ(ゾルミトリプタン)
- 第二世代のトリプタン製剤になります。効果が強めですが、やや眠気の副作用も強い印象です。
- 通常の錠剤の他にRM錠と言う口腔内速溶錠があり、どこでも飲めます。
●レルパックス(エレトリプタン)
トリプタン製剤が初めての方には、薬の効きも早く中枢性の副作用や首や胸の締め付け感が少ないレルパックス(エレトリプタン)をお勧めします。
授乳中での使用も問題ないというエビデンスもあり産後の方にも比較的使いやすいのが特徴です。

●ゾーミック(マクサルト)
マクサルト(リザトリプタン)は通常の錠剤の他にRPD錠と言う口腔内崩壊錠(口の中で溶けやすい)があります。
小児領域でのデータが多くあり、エレトリプタンと並び小児に使いやすいとされています。
●アマージ(ナラトリプタン)
月経関連や発作期間が長い方には、半減期の長いアマージ(ナラトリプタン)がお勧めです。副作用も少ないです。
片頭痛の予防治療
片頭痛は月2回以上発作がある場合は、予防治療をお勧めします。
予防治療により発作の頻度、発作の際の痛みの強さを改善する事ができます。
当院で主に用いる予防薬は下記になります。
●ミグシス(塩酸ロメリジン)
当院で片頭痛と診断した方のファーストチョイスとなるお薬です。Ca拮抗薬です。ミグシスを使用することで、発作回数や頭痛の程度の軽減、発作治療薬の減量、片頭痛による前駆症状の改善などの効果が期待できます。このお薬は脳の血管に選択的に作用する特徴があり、血圧低下等はほんとありません。血管の収縮と拡張の差を少なくして片頭痛発作を軽減します。血管の収縮、拡張を安定させて減らす事により頭痛が誘発される事を減らします。効果発現まで早い人でしたら1週間で効果を実感できます。通常は1カ月~3カ月程度で効果を見極めていきます。臨床では、効いている!!と言って頂ける方の割合は60%〜70%位の印象です。
●インデラル(β遮断薬:プロプラノロール)
元々このお薬も血圧降下、血管拡張作用のお薬です。これ以外の使用には、本態性振戦、血圧のお薬として使われます。このお薬も血管の、収縮拡張に作用し頭痛頻度を減らすとされております。妊娠中の片頭痛予防にも使います。
30 mg/日から開始し30~60mg/日の用量とする。

●デパケン(バルプロ酸)
元々、てんかんのお薬です。ミグシスが登場する以前より使われていました。眠気の副作用が強めですが、効果も期待できます。500mg~600mg/日の内服が勧められます。ミグシスで効果が今いちだった方にお勧めしています。

●トリプタノール(アミトリプチリン)
片頭痛をこじらせてしまった人に効果的なお薬です。元々は、抗うつ剤ですが少量投与により痛み止めに頼っている人に効果的です。(視調節障害、鼻閉、口渇、頻脈、便秘、排尿障害、緑内障には禁忌とされています)
使用量は低用量(10~20mg/日、就寝前)で使います。
近年は、ヒト化抗CGRPモノクローナル抗体の注射薬による予防治療も行われております。
エムガルティは、イーライリリー・アンド・カンパニーにより創製されたヒト化抗CGRPモノクローナル抗体で、新規作用機序をもつ片頭痛発作の発症を抑制する薬剤として開発されました。
カルシトニン遺伝子関連ペプチド(CGRP)は片頭痛発作時に上昇することが知られており、本剤はCGRPに選択的な結合親和性を有し、その活性を阻害することで、片頭痛発作の発症を抑制することが期待されます。副作用も、内服の予防薬に比べ非常に少ない為、内服で効果が得られなかった、内服での副作用が出る方には積極的にお勧めしています。
その他類似薬で、アジョビ、アイモビーグといったものが発売されています。
なお妊娠中の方は使用できるお薬が限られています。基本的は妊娠とともに、片頭痛は軽減し、発作頻度も減ります。妊婦で不安がある方はお気軽にご相談ください。
新規予防薬
ヒト化抗CGRPモノクローナル抗体の注射薬による予防治療
『エムガルティ・アジョビ・アイモビーグ』について動画でもご覧いただけます
頭痛に使う漢方一覧
●呉茱萸湯(ごしゅゆとう)
吐き気や、嘔吐を伴った、激しい頭痛に使います。頓用でも使え、連日の頭痛では、予防薬としても使えます。慢性頭痛の治療では、ロメリジン(ミグシス)と比較しても良好な治療成績が出ています。
当帰四逆加呉茱萸生姜湯(とうきしぎゃくかごしゅゆしょうきょうとう)
頭痛、腹痛、月経痛等を伴う場合にも使います。
●五苓散
低気圧時の頭痛、めまいを伴う方に使います。緊張型頭痛にも効果があります。
(半夏白朮天麻湯(はんげびゃくじゅつてんまとう)
五苓散と同様に低気圧で増悪するような頭重感でめまいが出やすい場合に使います。特に気圧の変動が大きい方に使います。
●当帰芍薬散(とうきしゃくやくさん)
月経周期に関連のある片頭痛に使います。むくみ除去にも使え、妊娠中も使えるお薬です(元々、流産予防としても使われていました)
●抑肝散
イライラ傾向で神経質であったり、ストレスを受けやすい方に使います。
当院での治療薬一覧
発作時治療薬
- カロナール
- セレコックス
- スマトリプタン(イミグラン)
- ゾルミトリプタン(ゾーミック)
- エレトリプタン(レルパックス)
- リザトリプタン(マクサルト)
- ナラトリプタン(アマージ)
予防薬
- トピラマート
- アミノトリプチン(トリプタノール)
- バルプロ酸
- ロメリジン(ミグシス)
- プロプラノロール(インデラル)